Mitazalimab
Mitazalimab är Alligators ledande CD40‑agonist, redo för fas 3-studier inom spridd bukspottkörtelcancer. Resultat från fas 2‑studien OPTIMIZE‑1 visar en tredubblad 24‑månaders överlevnad jämfört med standardbehandling. Kandidaten är en central del i Alligators tumörriktade immunterapiportfölj med stor potentiell klinisk påverkan.
Projektsammanfattning
Target: CD40
Indikation: spridd bukspottkörtelcancer (inledningsvis)
Utvecklingsfas: Fas 3-förberedande (positiva data från OPTIMIZE-1, fas 2)
Nyckeldata: Överlevnad vid 24 månader 29,4 % vs ~8 %; bekräftad ORR 42,1 %
Regulatorisk status: Stöd för fas 3 från FDA och PEI erhölls i början av 2025
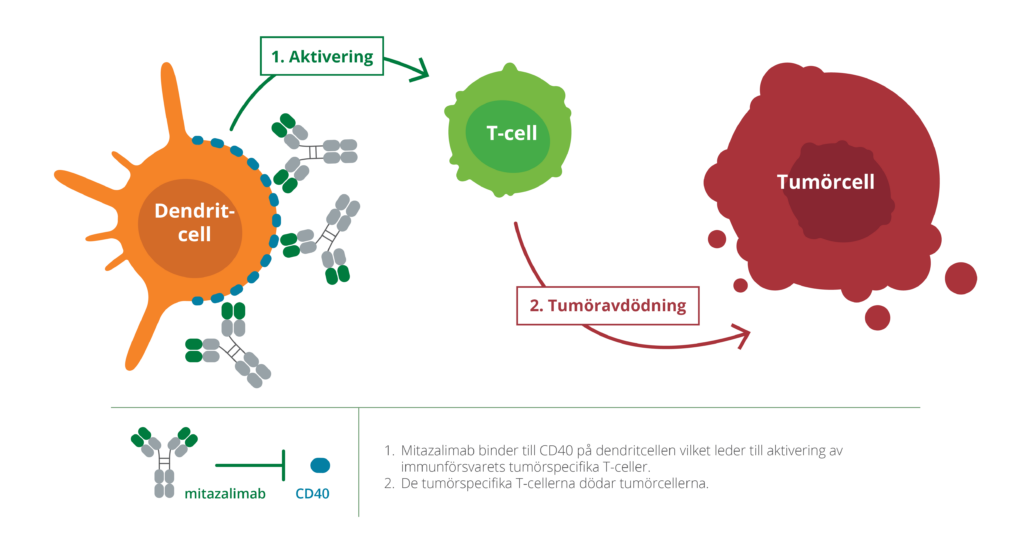
Mitazalimab är en aktiverande antikropp riktad mot CD40, en receptor på immunsystemets dendritceller, celler som upptäcker cancerceller i kroppen. Mitazalimabs aktivering av CD40 gör att dendritcellerna mer effektivt kan aktivera immunsystemets vapen – i detta fall T-celler – och rikta immunsystemets attack specifikt mot cancern. Mitazalimab har i prekliniska modeller visats framkalla ett kraftfullt tumörriktat immunsvar och ge långvarig immunitet mot tumörer. Vidare har prekliniska resultat visat att mitazalimab kan användas mot ett stort antal olika cancerformer och även i kombination med ett antal andra behandlingsformer, som t.ex. kemoterapier, vaccin och checkpointhämmare.
Klinisk fas 2 i bukspottkörtelcancer
Hittills har tre kliniska fas 1-studier och en klinisk fas 2-studie utförts med mitazalimab. Den första studien genomfördes av Alligator med fokus på intratumoral administrering. Kliniska data från den andra fas 1-studien, utförd av Janssen Biotech, Inc. på patienter med olika solida tumörer, visade att mitazalimab är säkert och tolereras väl vid kliniskt relevanta dosnivåer. I studien sågs även tidiga tecken på klinisk aktivitet, inklusive partiell respons hos en njurcancerpatient och tio patienter som förblev stabila i sin sjukdomsutveckling under minst sex månader.1 Mitazalimab har även utvärderats i kombination med cancervaccinet MesoPher i en prövarinitierad fas 1-studie, REACTIVE-2, hos patienter med tidigare behandlad spridd bukspottkörtelcancer, där den sista patienten doserades under 2023.
Biomarkördata från den av Janssen genomförda kliniska fas 1-studien bekräftar mitazalimabs verkningsmekanism och visade bland annat aktivering av makrofager, dendritiska celler och T-celler som är avgörande för att förstöra tumörceller och därefter klinisk respons.1 Dessa data bekräftades och utökades i en studie som beskriver de farmakodynamiska förändringarna genom att analysera gentranskription i immunceller från patienter efter administrering av mitazalimab.2 Tillsammans validerar biomarkördata mitazalimabs verkningsmekanism; aktiveringen av immunsystem i cancerpatienter.
Den kliniska fas 2-studien OPTIMIZE-1 är en öppen multicenterstudie som utvärderar säkerheten och effekten av mitazalimab (CD40-agonist) i kombination med kemoterapin mFOLFIRINOX, hos patienter som inte tidigare behandlats med kemoterapi. Kliniska data från fas 2-studien har visat att mitazalimab i kombination med mFOLFIRINOX ger betydande överlevnadsfördelar för patienter med bukspottkörtelcancer jämfört med standardbehandling.
Projektstatus
Nyligen rapporterade resultat
- Survival rate vid 24 månader låg på 29,4 procent hos patienter som behandlades med mitazalimab i kombination med mFOLFIRINOX, en tredubbling av estimat om 8 procent för enbart kemoterapin FOLFIRINOX3.
- Median Overall Survival (mOS) låg på 14,9 månader4, ett resultat som står sig väl i jämförelse med rapporterade 11,1 månader för FOLFIRINOX3, och mer nyligen för NALIRIFOX5.
- Vid brytpunkten för analysen vid 24 månader var 16 (28 procent) av patienterna fortsatt vid liv, och 5 (9 procent) kvarstod på behandling. Den längsta pågående behandlingen var 32 månader.
- Den bekräftade Objective Response Rate (ORR) låg på 42,1 procent4, ett resultat som står sig väl med en rapporterad ORR på 31,6 procent hos en liknande patientpopulation som enbart behandlats med FOLFIRINOX3 och en ORR på 42 procent som rapporterats för NALIRIFOX5. Obekräftad ORR låg på 54,4 procent hos de 57 patienter som utvärderades.4
- Median Duration of Response (DoR) vid 18-månadersanalysen låg på 12,6 månader4 vilket bekräftades vid 24-månadersanalysen; ett enastående resultat i denna aggressiva sjukdom och betydligt längre än de 5,9 månader som rapporterats för FOLRIFINOX3, och 7,3 månader som rapporterats för NALRIFOX4.
- Mitazalimab beviljades särläkemedelsstatus för behandling av bukspottkörtelcancer den 18 maj 2023 i USA och den 21 augusti 2023 i EU.
Mitazalimab ger långvariga överlevnadsfördelar i kombination med kemoterapi
OPTIMIZE-1 är en öppen multicenter-studien i fas 2 som utvärderar effektivitet och säkerhet av mitazalimab i kombination med kemoterapi (mFOLFIRINOX) hos patienter med spridd bukspottkörtelcancer, vilka inte tidigare behandlats med kemoterapi. Lovande data har löpande rapporterats från studien där 57 patienter utvärderats, och den nyligen rapporterade positiva avläsningen vid 24 månaders uppföljning i första kvartalet 2025 är ett betydande delmål som särskiljer mitazalimab från många andra behandlingar under utvärdering för denna svåra sjukdom.
Efter amerikanska FDA:s rekommendationer för att säkra att mitazalimab är väl förberedd för utvärdering i fas 3, har Alligator rekryterat patienter till ytterligare en doskohort om 450 µg/kg för att stödja doskaraktäriseringen av kandidaten. Topline-data rapporterades i februari 2025, och indikerade en positiv koppling mellan dos och respons för mitazalimab, vilket ger ytterligare stöd för valet av 900 µg/kg som dos för fas 3.
Utveckling bortom fas 2
Alligator har efter diskussioner med amerikanska FDA och europeiska tillsynsmyndigheter under 2024 och under första kvartalet 2025 fastställt en tydlig väg mot marknadsgodkännande för mitazalimab i första linjens behandling av spridd bukspottkörtelcancer, och fått bekräftat att studien OPTIMIZE-1 möjliggör för utvärdering i fas 3, vilket meddelades i februari 2025. En CMC-interaktion med FDA i december 2024 bekräftade tidigare återkoppling från tyska Paul Erlich Institute (PEI) och säkerställde att även slutfört och planerat CMC-arbete möjliggör fas 3-start. Efter detta positiva utfall har Alligator inlett tillverkningsprocessen av material för fas 3.
Alligator planerar att gå direkt vidare till en global fas 3-studie med möjlighet till accelerated approval, som förbereds inför ett partnerskap för start under andra halvan av 2025. För att stödja detta utökades OPTIMIZE-1-studien under 2024 med 15 ytterligare patienter vid 450 µg/kg, i linje med FDA:s vägledning från december 2023. Rekryteringen av dessa patienter avslutades i juli 2024 och data för exponering och svar på behandling rapporterades i februari 2025. Resultaten visade en ORR på 22.7 % (obekräftad), att jämföra med 54.4 % för 900 µg/kg-dosen, vilket indikerar en positiv koppling mellan dos och respons för mitazalimab och ger ytterligare stöd för valet av 900 µg/kg som dos för fas 3.
Den slutliga fas 3-designen presenterades för FDA vid ett ”End of Phase 2 meeting” i januari 2025. Både FDA och PEI har nu bekräftat att den föreslagna fas 3-designen kan ligga till grund för ansökningar om Biologics License Application (BLA) och Market Authorization Application (MAA).
1 Invest New Drug. 2023 Feb;41(1):93-104. doi: 10.1007/s10637-022-01319-2.
2 Cells. 2023 Sep 27;12(19):2365. doi: 10.3390/cells12192365.
3 N Engl J Med 2011; 364:1817-1825; doi: 10.1056/NEJMoa1011923.
4 Lancet Oncol. 2024 Jul;25(7):853-864; doi: 10.1016/S1470-2045(24)00263-8.
5 Lancet. 2023 Oct 7;402(10409):1272-1281; doi: 10.1016/S0140-6736(23)01366-1