ATOR-1017
ATOR-1017 är en monoklonal antikropp som aktiverar receptorn 4-1BB på T-celler och NK-celler i tumören. Molekylen utvecklas för behandling av spridd cancer.
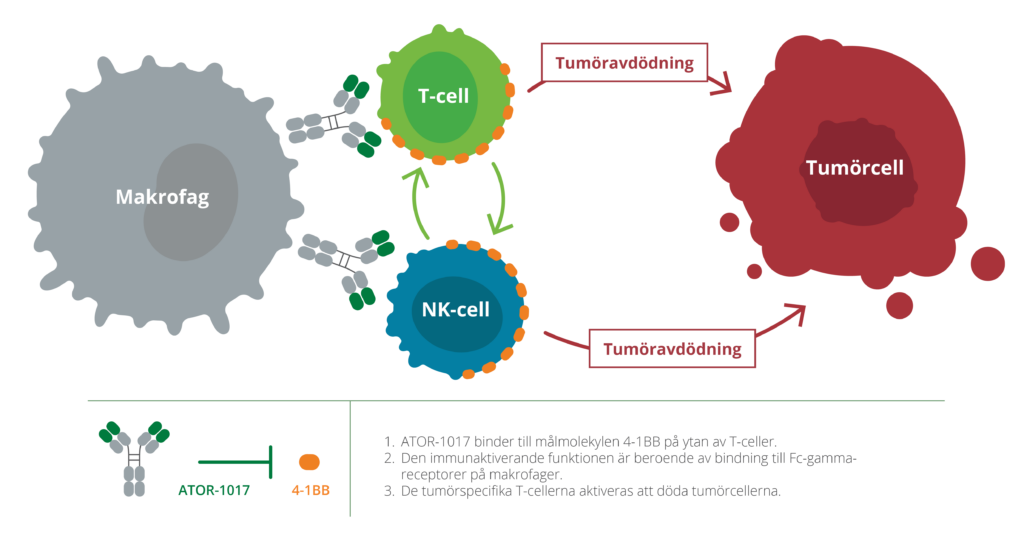
ATOR-1017 aktiverar 4-1BB-receptorer vilket ökar immunsystemets förmåga att upptäcka och avdöda tumörceller, vilket gör 4-1BB till ett högintressant mål för immunterapi av cancer. ATOR-1017 förstärker immunaktivering i miljöer där det finns många immunceller, vilket särskilt förekommer i tumörer. Detta skapar möjligheter för en kraftfull, tumörriktad immunaktivering som kan öka effekten och minska biverkningarna för patienten.
Projektstatus
Lovande data i klinisk fas 1
ATOR-1017 skiljer sig tydligt från andra 4-1BB-antikroppar, dels genom sin unika bindningsprofil, dels genom att den immunaktiverande funktionen är beroende av korsbindning till så kallade Fc-gamma-receptorer på immunceller. Detta lokaliserar immunaktiveringen till tumörområdet där både 4-1BB och Fc-gamma-receptorer är högt uttryckta.
En rad prekliniska data har presenterats som visar att ATOR-1017 aktiverar både NK-celler och T-celler, vilka båda bidrar till en effektiv immunmedierad avdödning av tumörceller. Aktiverande antikroppar mot 4-1BB stärker därför både NK-cellers och T-cellers förmåga att angripa tumörceller. En fas 1-dosbestämningsstudie i patienter med spridd cancer avslutades under fjärde kvartalet 2022 med lovande säkerhets- och farmakologiska data, och Alligator är nu i färd med att identifiera en partner innan kliniska fas 2-studier med ATOR-1017 inleds.
Klinisk fas 1-studie genomförd
Sedan 2020 har Alligator löpande offentliggjort säkerhets- och biomarkördata avseende ATOR-1017-fas 1-studien i patienter med spridd cancersjukdom.
I november 2022 offentliggjorde Bolaget att studien var klar och presenterade topline-data från studien vid årsmötet för SITC i Boston, USA. Data bekräftade den gynnsamma säkerhetsprofilen för läkemedelskandidaten utan några rapporterade allvarliga immunrelaterade biverkningar, ens vid den högsta dosen om 900 mg. Dessutom validerades verkningsmekanismen hos ATOR-1017 genom data som visade att läkemedelskandidaten är farmakologiskt aktiv vid doser över 100 mg. Studien visade tecken på klinisk nytta, där ATOR-1017 gav en sjukdomskontrollgrad på över 50 procent, med sex patienter som visade stabil sjukdom i mer än sex månader. Två patienter uppvisade stabil sjukdom i mer än 12 månader och två patienter studerades fortfarande den 31 augusti 2022, den sista datumfristen för data.
Alligator har en fortsatt stark tro på 4-1BB agonistområdet och ATOR-1017 och söker en projektpartner innan kliniska fas 2-studier inleds med molekylen.